取得系列进展
近期,我院动物发育生物学研究团队刘庆信教授和周紫章教授课题组在细胞发育与凋亡领域取得系列进展,相关研究成果分别发表在国际著名期刊《Cell Death and Differentiation》《Cell Death & Disease》《Cell Death Discovery》,揭示了调控细胞迁移及凋亡的新机制,加深了对昆虫翅脉发育的认识。
恶性肿瘤严重威胁着人类生命健康,已成为全世界人类死亡的主要原因。肿瘤转移,而不是原发性肿瘤的过度生长,是肿瘤引起死亡的主要原因。恶性肿瘤细胞的转移是一个由多种基因控制的复杂过程,其潜在调控机制还尚不清楚。
2022年3月31日,国际知名期刊《Cell Death & Disease》(IF=8.7126)在线发表了山东农业大学生命科学学院刘庆信和周紫章课题组题为“Usp8 promotes tumor cell migration through activating the JNK pathway”的研究论文,揭示了去泛素化酶Usp8通过激活JNK信号通路调控肿瘤细胞迁移的机制。

通过遗传筛选发现,在果蝇中过表达去泛素化酶Usp8能够诱导细胞迁移,并且激活JNK信号通路。免疫荧光染色发现,阻断JNK信号通路活性能够有效地抑制Usp8过表达诱导的肿瘤细胞迁移。同时发现过表达Usp8能够引起JNK通路经典靶基因puc-lacZ和Mmp1表达水平显著升高,并且Usp8同样激活pJNK蛋白水平,表明Usp8通过激活JNK通路活性诱导肿瘤细胞迁移。
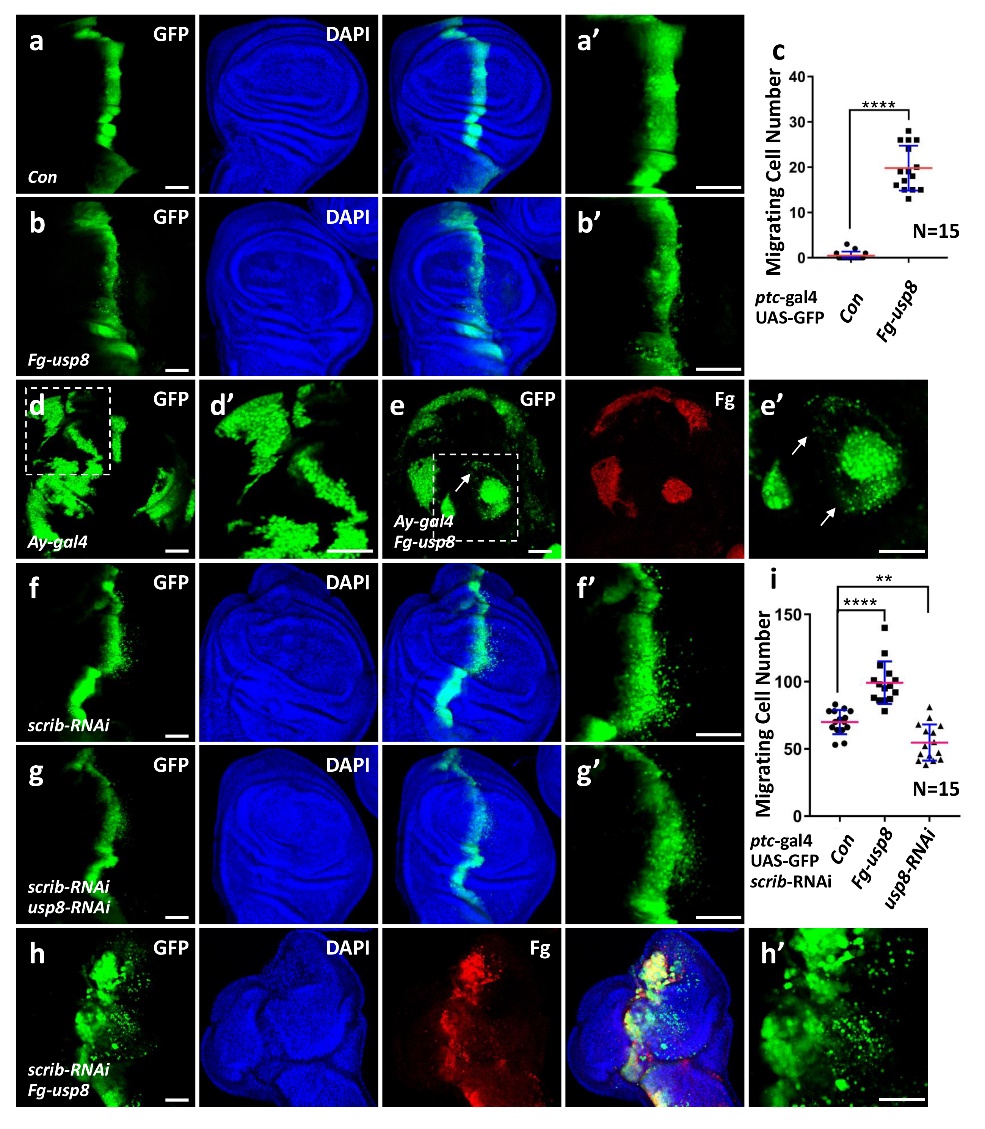
过表达去泛素化酶Usp8诱导细胞迁移
Co-IP及GST pull-down结果显示,Usp8和JNK通路核心元件Tak1存在相互作用,并且Usp8是通过减少Tak1上K48和K63连接的泛素化来稳定Tak1。此外,Usp8调控JNK通路及细胞迁移从果蝇到哺乳动物是高度保守的,Transwell分析显示人源USP8显著促进了乳腺癌细胞的迁移,而USP8的敲降则抑制了乳腺癌细胞的迁移。
综上所述,本研究发现去泛素化酶Usp8通过稳定Tak1激活JNK通路活性,并促进肿瘤细胞迁移。本研究一方面拓展对翻译后修饰水平精细调控JNK信号通路活性及细胞迁移的认识,同时也将为JNK诱导的乳腺癌转移提供新的治疗靶点。
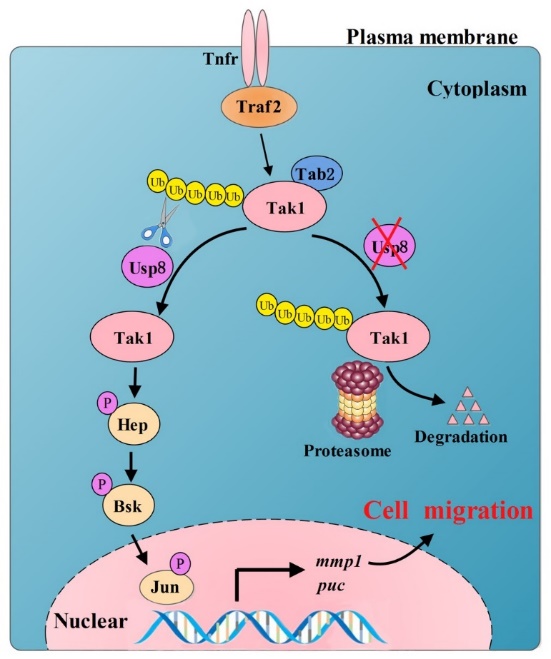
Usp8通过JNK通路调控细胞迁移的模式图
山东农业大学生命科学学院博士后赵云贺和中国药科大学博士研究生彭德振是该论文的共同第一作者,山东农业大学生命科学学院刘庆信教授和周紫章教授是本文的共同通讯作者。山东农业大学生命科学学院硕士研究生刘艳云、张倩、刘斌、丁文浩及中国药科大学邓嫣然博士参与了部分工作。该研究得到了国家自然科学基金(31802012, 31922011, 31872971)、国家重点研发计划(2017YFE0129800)、山东省自然科学基金(ZR2020QC055)、中国博士后科学基金(2019M662414)及泰山学者专项基金(Ts201712022)的资助。
全文链接:https://www.nature.com/articles/s41419-022-04749-1
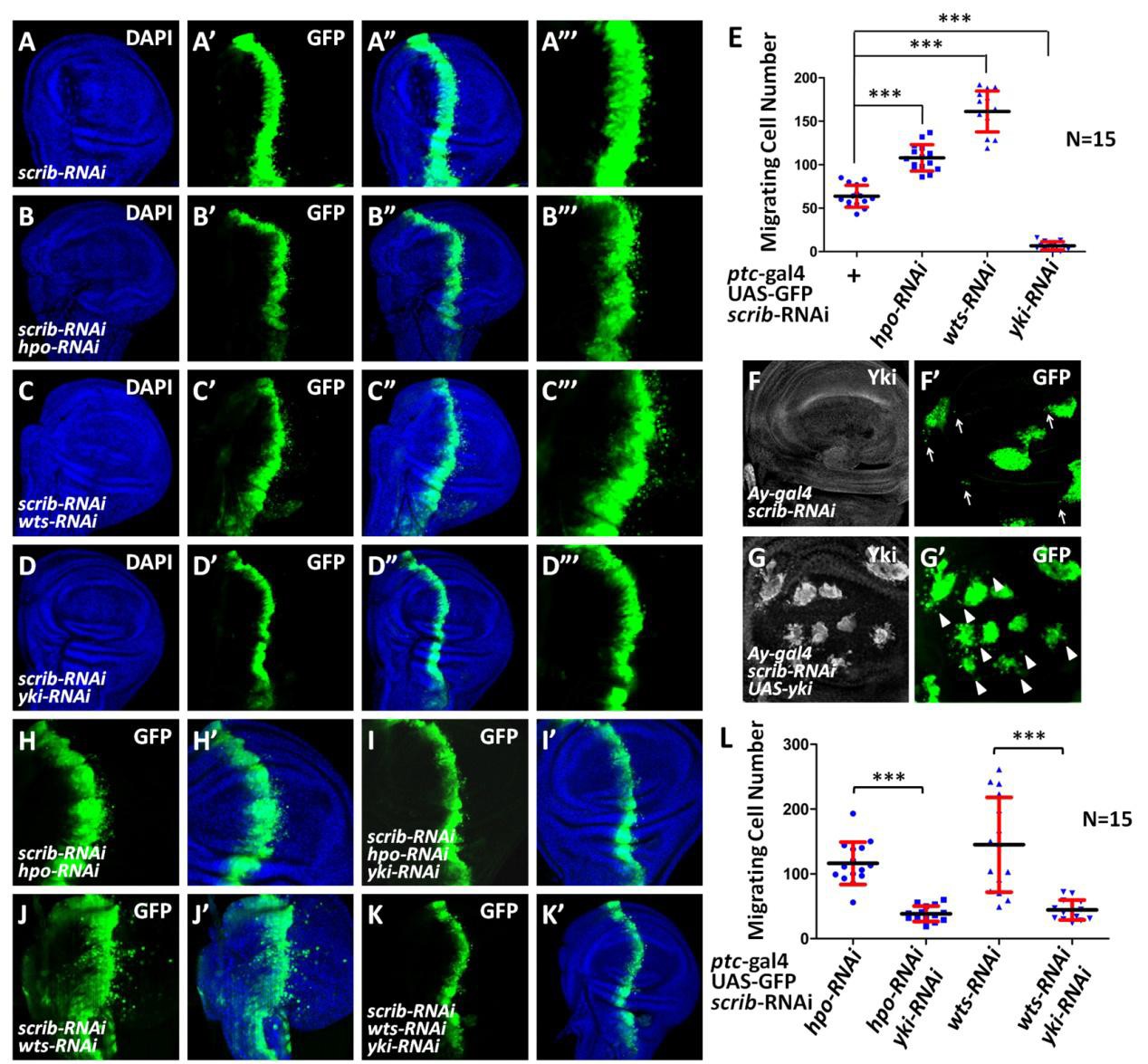
2.Hippo信号通路通过Yki-Src42A正反馈回路调控细胞迁移
Hippo通路通过一系列的激酶级联反应调控下游的转录辅助因子Yki,从而调控与细胞增殖和细胞凋亡的靶基因表达。但是,Hippo信号如何调控细胞迁移及其调控机制尚不清楚。
2021年12月3日,国际知名期刊《Cell Death & Disease》(IF=8.7126)在线发表了山东农业大学生命科学学院刘庆信和周紫章课题组题为“Hippo signaling suppresses tumor cell metastasis via a Yki-Src42A positive feedback loop”的研究论文,阐述了Hippo信号通路介导的Yki-Src42A正反馈回路调控细胞迁移的机制。

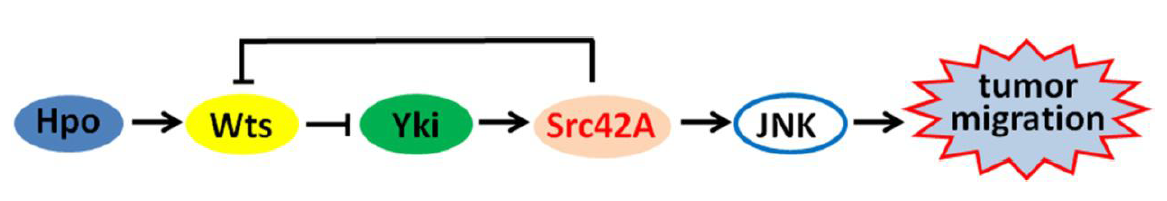
利用果蝇中探究细胞迁移的经典模型,发现敲降hippo和wts均能导致细胞迁移,而敲降yki则能有效的抑制细胞迁移。通过遗传筛选发现,Yki能够激活Src42A的表达,而敲降src42a能够有效抑制Hippo通路失活诱导的细胞迁移。进一步研究发现,Src42A能够抑制Hippo通路活性,进而促进通路下游靶基因的表达,表明src42A是Yki活性的一个正反馈调节因子。
Hippo信号通路失活诱导细胞迁移
总之,本研究揭示了Hippo信号通路通过Yki-Src42A正反馈回路调控细胞迁移的机制,加深了对肿瘤细胞迁移的认识,为Hippo通路失活诱导的肿瘤细胞转移的治疗提供潜在的治疗靶点。
山东农业大学生命科学学院博士研究生丁燕、南开大学博士研究生王桂
、珠海市人民医院占美晓副研究员以及山东农业大学博士研究生孙小涵是该论文的共同第一作者,山东农业大学生命科学学院周紫章教授、刘庆信教授和南开大学吴世安教授是本文的共同通讯作者。该研究得到了国家自然科学基金(31802012, 31970733, 31922011)、国家重点研发计划(2017YFE0129800)、山东省重点研发计划项目(2019GGX102084)、山东省高校科研创新青年团队计划项目(2019KJE009)及泰山学者专项基金(Ts201712022)的资助。
全文链接:https://doi.org/10.1038/s41419-021-04423-y
3.Hh信号通路通过Rdx调控细胞凋亡
细胞凋亡(apoptosis)指细胞为了维持其内部环境的稳定,由基因控制的细胞自主有序的死亡过程。细胞凋亡受到多种信号通路调控,细胞凋亡过程的异常会导致多种先天缺陷和人类疾病。Hedgehog(Hh)信号通路是在进化中高度保守的原癌信号通路,参与调控胚胎发育、干细胞维持和肿瘤发生等多种过程。然而,Hh通路是否以及如何调控细胞凋亡尚不清楚。
2021年9月24日,该团队在《Cell Death Discovery》期刊(IF=5.3017)发表了题为“The Hh pathway promotes cell apoptosis through Ci-Rdx-Diap1 axis”的研究论文,揭示了Hh通路调控细胞凋亡的机制。

利用模式生物黑腹果蝇进行遗传筛选发现,过表达Hh通路上游元件Smo或Ci均能加剧促凋亡因子Hid引起的果蝇眼睛变小的表型。利用免疫荧光染色发现激活Hh通路能够诱导凋亡信号的增加。
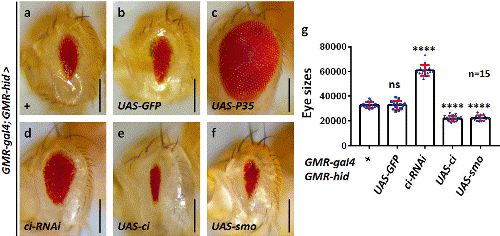
Hh通路调控Hid诱导的眼睛变小的表型
已知Hh通路有4个经典的靶基因,分别为dpp、en、ptc和rdx。发现过表达Rdx能够加剧Hid诱导的眼睛变小的表型,而敲降Rdx能部分挽救Hid诱导的表型,表明Hh通路通过靶基因rdx来调控细胞凋亡。进一步细胞实验揭示了E3泛素连接酶Rdx与重要的凋亡抑制蛋白Diap1存在相互作用,并且与凋亡蛋白Dronc竞争性结合Diap1,使Dronc蛋白稳定,进而引发细胞凋亡。
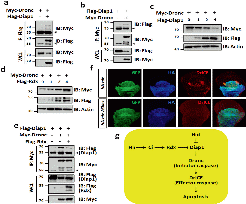
Hh通路调控细胞凋亡的模式图
总之,本研究揭示了原癌信号通路Hh通路能够通过Ci-Rdx-Diap1轴调控细胞凋亡,不仅拓展了Rdx的新功能,更发现了原癌信号通路正调控细胞凋亡过程,为临床上治疗Hh通路相关的肿瘤提供了新思路。
山东农业大学生命科学学院硕士研究生刘斌和博士研究生丁燕是该论文的共同第一作者,山东农业大学生命科学学院周紫章教授和珠海市人民医院占美晓副研究员是本文的共同通讯作者。山东农业大学生命科学学院刘庆信教授参与了部分工作。该研究得到了国家自然科学基金(31802012, 31922011, 81901857)、山东省重点研发计划项目(2019GGX102084)、山东省高校科研创新青年团队计划项目(2019KJE009)及泰山学者专项基金(Ts201712022)的资助。
全文链接:https://doi.org/10.1038/s41420-021-00653-3
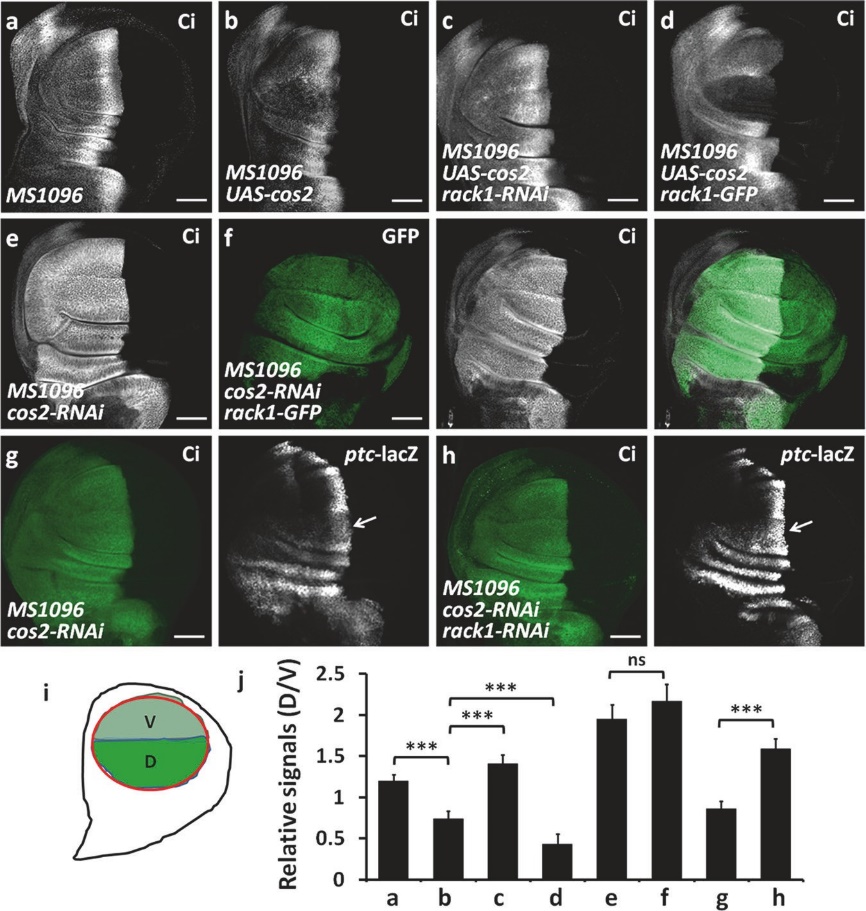
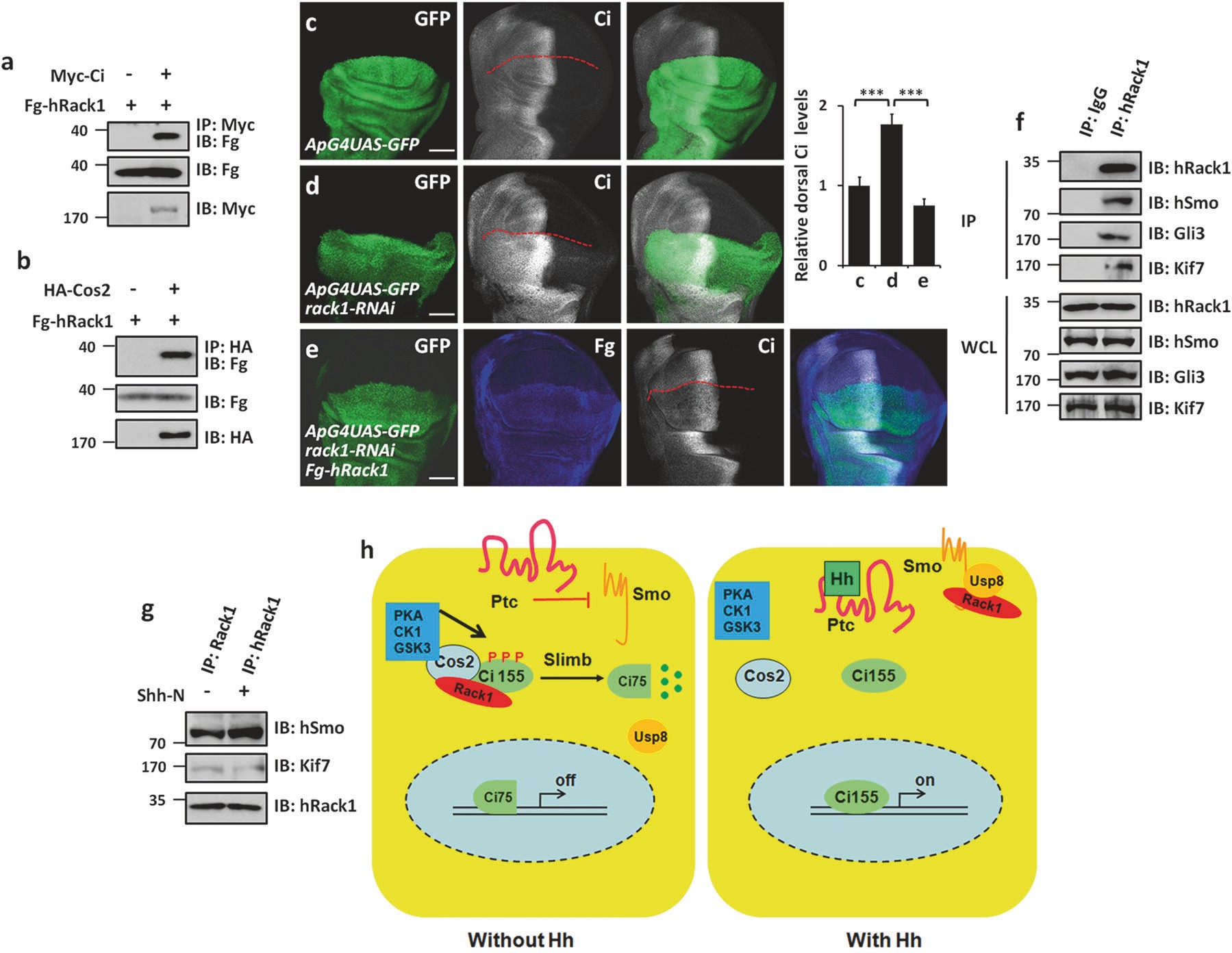
4.支架蛋白Rack1通过调控Hh信号通路的活性,调节翅脉的发育
Hh信号通路于1980年通过果蝇突变体筛选被发现。该发现获得1995年诺贝尔奖。Hh信号通路通过转录因子Ci调控翅脉发育,影响翅形状。Hh作为分泌蛋白,与膜表面受体Ptc结合,促进另一个膜蛋白Smo在细胞膜上积累。Smo将胞外信号传递至细胞内,调控转录因子Ci的稳定性,促进下游靶基因表达。正常生理状态下,Hh信号通路的活性受到严格调控,一旦失调,将带来致命性危险。但是,至今为止,Hh信号如何稳定转录因子Ci?Hh信号如何促进Smo蛋白细胞膜积累?尚不清楚。
2020年5月28日,山东农业大学生科院刘庆信课题组和周紫章课题组合作在国际著名期刊《Cell Death and Differentiation》(IF=15.8284)上在线发表了题为“Dual functions of Rack1 in regulating Hedgehog pathway”的研究论文,阐述了支架蛋白Rack1通过调控Hh信号通路的活性,调节翅脉的发育。

研究团队通过筛选,发现敲降Rack1导致翅脉分布异常。进一步分析发现,Rack1调控Hh信号通路活性。当Hh通路处于失活状态,支架蛋白Rack1促进Ci泛素化降解;当Hh通路处于激活状态,Rack1与Ci解离,Rack1与Smo蛋白结合,促进Smo蛋白细胞膜积累。这表明,支架蛋白Rack1作为分子开关,控制Hh信号通路“活化/失活”的转化。本研究加深了对昆虫翅脉发育的认识。
Rack1与Cos2协同降低Ci蛋白水平
Rack1调控Hh信号通路活性的模式图
山东农业大学生科院硕士研究生李妍和孙小涵是该论文的共同第一作者。刘庆信教授和周紫章教授为该论文的共同通讯作者。该研究得到了国家自然科学基金(31571502, 31872971, 31802012, 31922011)、国家重点研发计划(2017YFE0129800)、山东省自然科学基金项目(ZR2017MC014)等项目的资助。
全文链接:https://www.nature.com/articles/s41418-020-0563-7


 返回顶端
返回顶端


