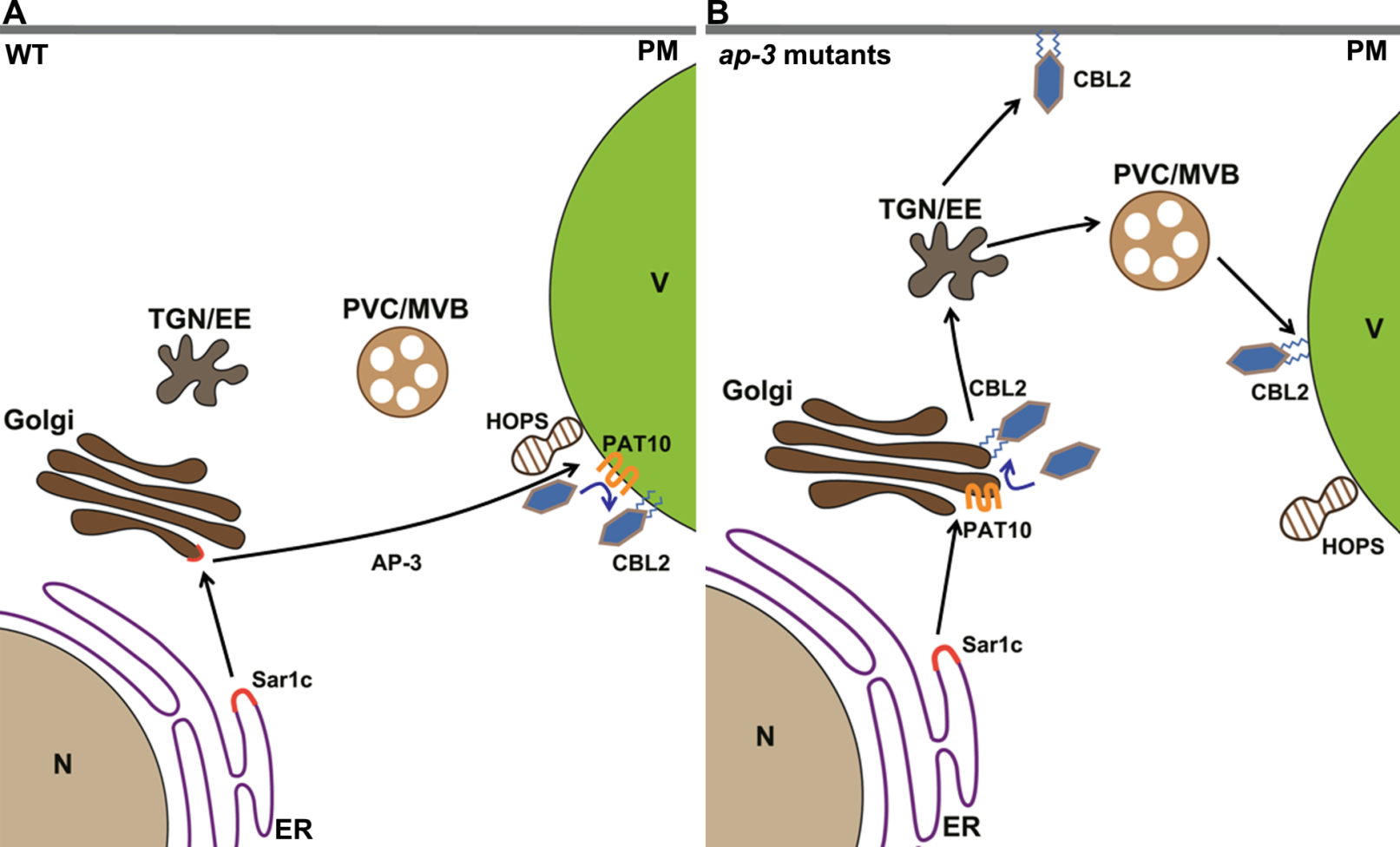
5月30日,我院张彦课题组在《Plant Physiology》上在线发表题为《AP3 adaptor protein-dependent vacuolar trafficking involves a subpopulation of COPII and HOPS tethering proteins》的研究文章。该论文报道了衔接蛋白复合体3介导拟南芥棕榈酰基转移酶10(PAT10)靶向液泡的运输途径,并且发现COP的小G蛋白SAR1c和HOPS复合体的VPS41亚基也参与了该运输过程。
植物液泡作为植物中特有的细胞器,通过调控离子平衡、次生代谢物质储存维持渗透压等参与植物响应环境信号、生长发育等过程。定位在液泡膜上的离子转运蛋白、酶类等对于液泡发挥这些功能至关重要。这些蛋白质从内质网(ER)合成后可以通过四条囊泡运输途径到达液泡膜。目前研究的较为清楚的途径是依赖COPII复合体,由高尔基体加工修饰,经反式高尔基网络/早期内吞小体(TGN/EE)和液泡前体(PVC/MVB)分拣到达液泡。该途径可以分为由Rab5单独介导和由Rab5、Rab7共同介导的两条途径,且这两条途径在进化上均非常保守。此外,还有依赖适配蛋白复合体AP-3以及由内质网直接到达液泡的独立演化的运输途径,但后者的分子机制至今尚不清楚。本研究中,利用小G蛋白Rab-DN(Dominant negative)不能阻断PAT10定位到液泡膜上,证明了PAT10通过非经典液泡运输途径靶向液泡膜。利用基于荧光的正向遗传方法对PAT10g-GFP材料进行了EMS诱变,通过对花粉管中PAT10定位的筛选,发现了两株影响其定位的突变体,通过图位克隆和测序发现这两个位点是AP-3δ亚基上的两个点突变。通过酵母双杂交和稳定转基因方法,发现这两个位点的突变影响了AP-3复合体的形成和亚细胞定。通过荧光双标发现PAT10在ap-3δ中的定位变成高尔基体。该研究中还报道了CBL2在ap-3δ中定位也发生了改变,不仅有液泡膜的定位还有一部分质膜的定位。在该研究中,利用COPII的小G蛋白SAR1c-DN阻断PAT10靶向液泡膜的过程,证明了PAT10经SAR1c运输从内质网到达高尔基体。文章中还证明了HOPS复合体的VPS41亚基也参与了PAT10与液泡膜的融合过程。
该文章利用分子、生化、细胞和遗传等手段探究了棕榈酰基转移酶PAT10的液泡运输途径中的调控因子,为研究非经典的液泡运输途径的调控机理提供了新线索。
张彦实验室博士生冯强楠为该论文的第一作者,硕士生宋士健、于世霞,王家刚博士,李厦副教授也参与了课题的研究。张彦教授为该论文的通讯作者。此项工作受到国家自然科学基金面上项目,山东省自然科学基金,山东省泰山学者人才建设工程项目等项目经费资助。
http://www.plantphysiol.org/content/early/2017/05/30/pp.17.00584.full.pdf+html